Casi todas las propiedades físicas del agua se deben a la existencia del enlace puente de hidrógeno entre sus moléculas.
El enlace puente de hidrógeno corresponde a la fuerza de atracción que existe entre un oxígeno de una molécula con un hidrógeno de una molécula vecina.
El enlace de hidrógeno hace que las moléculas de agua se mantengan unidas. Mientras que los enlaces de hidrógeno son relativamente débiles comparados a otro tipos de enlaces, son lo suficientemente fuertes como para darle al agua muchas propiedades únicas.
Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incomprensible.
El calor específico de una sustancia es la cantidad de calor que se requiere para elevar un grado Celcius la temperatura de un gramo de ella. Según esta definición, las unidades en que se expresa este calor son J/g ºC. Así el calor específico del agua es de 4,184 J/g. ºC ó 1 cal/g. ºC, valor que es anormalmente elevado cuando se le compara con los de otras sustancias.
Por lo tanto, el valor 4,184 J/g. °C implica que se necesita una gran cantidad de calor para calentar 1 g de agua o se desprende mucho calor cuando ésta se enfría.
La capacidad del agua para almacenar energía calorífica tiene consecuencias ambientales muy importantes. Una de estas es el clima. Así las áreas geográficas cercanas a los grandes lagos, mares u océanos experimentan fluctuaciones más pequeñas de temperatura, no sólo entre invierno y verano sino que también entre el día y la noche, que aquellas áreas situadas en el interior de los continentes. El agua de estos cuerpos puede absorber gran cantidad de calor en verano, mientras que su temperatura sólo aumenta ligeramente. En invierno los cuerpos desprenden calor con lo que la temperatura del agua baja levemente y en el ambiente hay menos frío.
La circulación del agua de la sangre de los organismos regulan la temperatura de los seres. Baste mencionar que el hombre posee alrededor de 2/3 de agua en su cuerpo y su temperatura normal es 36.5°C.
TENSIÓN SUPERFICIAL
Es la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido presenta una resistencia para aumentar su superficie, es decir, la tensión superficial de un líquido es la resistencia que opone a la penetración de cuerpos en él. Cabe suponer que los líquidos cuyas moléculas tengan fuerzas de atracción intermoleculares fuertes tendrán tensión superficial elevada. Puesto que las fuerzas intermoleculares de atracción entre moléculas de agua se deben a los enlaces de hidrógeno y éstos representan una alta energía, la tensión superficial del agua es mayor que la de muchos otros líquidos.
CAPILARIDAD
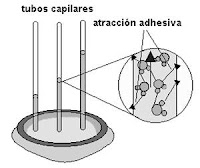 Es la subida espontánea de un líquido en un tubo estrecho (capilar). Se debe a la existencia de dos tipos de fuerzas diferentes: cohesivas que son las fuerzas entre las moléculas del líquido y adhesivas que son las fuerzas que operan entre las moléculas del líquido y el capilar. En el agua las fuerzas cohesivas corresponden a los enlaces de hidrógeno.
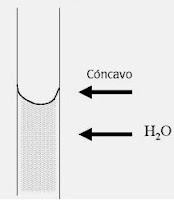
Es la subida espontánea de un líquido en un tubo estrecho (capilar). Se debe a la existencia de dos tipos de fuerzas diferentes: cohesivas que son las fuerzas entre las moléculas del líquido y adhesivas que son las fuerzas que operan entre las moléculas del líquido y el capilar. En el agua las fuerzas cohesivas corresponden a los enlaces de hidrógeno.El agua tiene la capacidad de ascender por las paredes de un tubo de vidrio capilar cuando la superficie del agua toca el vidrio, porque las fuerzas de adhesión agua-vidrio son mayores que las de cohesión agua-agua, por lo que el agua contenida en el capilar sube hasta que las fuerzas de atracción se hacen igual al peso de la columna de agua que se formó en su ascenso. El hecho que las fuerzas adhesivas en el agua sean mayores que las cohesivas, se manifiesta también en la formación de un menisco cóncavo (redondeado hacia abajo) en el extremo de la columna.
Fenómeno de capilaridad, que permite la ascensión de la savia en los vegetales.
DENSIDAD
Un líquido a presión atmosférica normal, aumenta su densidad según va disminuyendo la temperatura. El agua sigue esta misma ley, pero al llegar a los 4ºC invierte esta tendencia y baja su densidad según disminuye más la temperatura. Esto permite que el hielo sea menos denso que el agua, y por tanto, flote en vez de hundirse. Y esta propiedad impide que los mares y lagos se congelen.
Un líquido a presión atmosférica normal, aumenta su densidad según va disminuyendo la temperatura. El agua sigue esta misma ley, pero al llegar a los 4ºC invierte esta tendencia y baja su densidad según disminuye más la temperatura. Esto permite que el hielo sea menos denso que el agua, y por tanto, flote en vez de hundirse. Y esta propiedad impide que los mares y lagos se congelen.
Sin embargo, el agua líquida pura a los 4ºC tiene una densidad de 1 gr./ml, lo que significa que 1 ml pesa 1 gr.
PROPIEDADES TÉRMICAS
Los puntos de fusión y de ebullición son muy altos (0ºC y 100ºC), debido a la alta cohesión molecular debido a las uniones puente de hidrógeno. Esto es lo que permite que el agua sea líquida a temperatura y presión normales.
Elevado calor de vaporización. A 20ºC se precisan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar al estado de vapor.





No hay comentarios:
Publicar un comentario