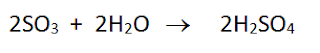Los gases emanados como óxidos de azufre, óxidos de nitrógeno, contribuyen a la formación de la lluvia ácida, según las siguientes ecuaciones:

Luego al mezclarse el anhídrido sulfúrico con las gotas de agua de la lluvia se tiene la siguiente reacción:


separare esta contaminación en biológica, química y física.
1.- Contaminación Biológica: Corresponde a los desagües domésticos urbanos, que tienen los siguientes componentes: Detergentes, restos de alimentos, excrementos, bacterias, virus, entre otros, que pueden llegar a producir serios problemas a la salud de la población.
Enfermedades como tifus, hepatitis, cólera y gastroenteritis pueden ser contraídas a través de este medio.
2.- Contaminación Química: provocada por actividades industriales, agrícolas, mineras y de transporte de materias primas (por ejemplo petróleo).
Las aguas residuales industriales pueden contener sustancias tales como metales pesados, solventes, colorantes, ácidos, álcalis y agua caliente.
a. Metales pesados: entre ellos están el mercurio (Hg), que por medio de la acción de bacterias pueden formarse sustancias tóxicas (metil mercurio), el cual daña el cerebro provocando demencia e incluso la muerte.
Después tenemos el plomo (Pb), que se utilizaba en la fabricación de la bencina, también se utiliza en la fabricación de plaguicida y en pinturas (color amarillo). Este metal daña al sistema nervioso, cerebro, la sangre, los riñones y también el sistema reproductor masculino. En nuestro país, Chile, los casos más emblemáticos se encuentran en Arica.
(ver http://www.profesorenlinea.cl/ecologiaambiente/ContaminacionPlomo.htm)
Le sigue en peligrosidad el cadmio (Cd), el cual es un subproducto de las actividades mineras, éste se bioacumula en algas, mariscos, vegetales y animales, llegando finalmente al ser humano. Produce daños serios en riñones, hígado y huesos, incluso es capaz de sustituir, en parte, el ion calcio (Ca 2+), presente en los huesos.
(http://www.lenntech.es/periodica/elementos/cd.htm)
El agua caliente, consecuencia de algunos procesos industriales, provoca una disminución de la cantidad de oxígeno disuelto en el agua, necesario para la existencia de animales y plantas.
Las actividades agrícolas son también causantes de contaminación, los plaguicidas y el exceso de fertilizantes, son altamente tóxicos.
Los fertilizantes que contienen generalmente nitratos y fosfatos, son causantes de la eutroficación de fuentes de agua con un curso lento. Además como llegan al mar, afectan a la flora y fauna provocando un fenómeno conocido como marea roja.
La eutroficación además de la proliferación excesiva de microalgas, algas y/o plantas acuáticas, emana malos olores por la putrefacción.
 |
| Ceratium tipos: dinoflagelado con placas |
 |
| Marea Roja |
Por último están los derrames de petróleo o marea negra, provocados por accidentes o prácticas inadecuadas. Este producto por ser menos denso que el agua queda en la superficie de esta, y además no se disuelve en ella (inmiscible).
Estos derrames afectan a la fauna de la zona marítima o litoral afectado, con consecuencias que persisten en el tiempo.
3.- Contaminación Física: Específicamente aquellos botados por el humano: bolsas plásticas, botellas plásticas, entre otros.
Además de verse con un aspecto desagradable la fuente de agua, puede provocar la proliferación de plagas y enfermedades.
Por ejemplo en el río Citarum, de Bandung, Indonesia; del cual la gente vive, el 2007 sufrió una considerable contaminación de basura.
En cuanto a la fauna marina, bolsas, tapas y botellas plásticas amenazan de muerte a gaviotas, albatros, delfines y tortugas.
fuentes bibliograficas:
- Química 1º Medio, Editorial mare nostrum.
- Química 1º Medio, Editorial Arrayán.